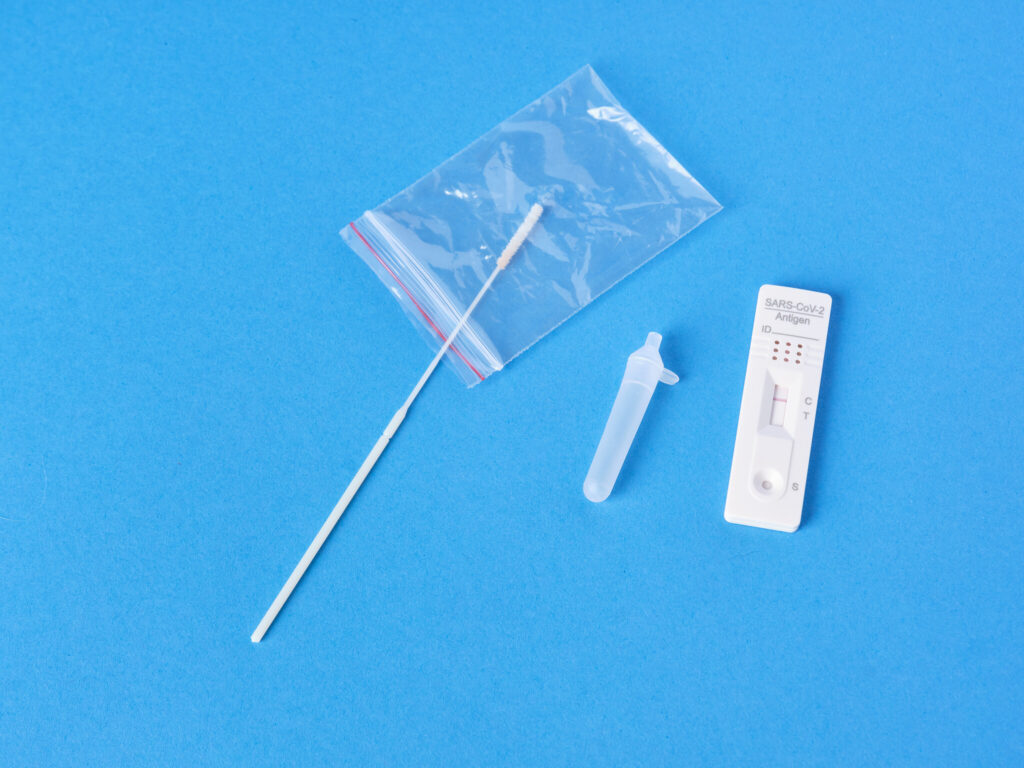
A Agência Nacional de Vigilância Sanitária (Anvisa) indicou nesta sexta-feira (7) que os chamados “autotestes” contra a covid-19, ministrado pelo próprio paciente, só podem ser registrados caso haja uma política de saúde pública e estratégia de ação estabelecida pelo Ministério da Saúde.
Em nota técnica, a Gerência-Geral de Tecnologia de Produtos para Saúde (GGTPS) da agência indicou que a aplicação destes produtos só depende de uma decisão da pasta comandada por Marcelo Queiroga, considerando sua utilização como ferramenta de combate à pandemia. “A definição de políticas públicas conduzem a medidas que viabilizam o controle de doenças e agravos, sendo imprescindível, que seu propósito seja claramente desenhado para assegurar a proteção da saúde da população e minimizar ao máximo os riscos”, indicou a agência.
Leia também
A agência lembra que outros países fazem uso do dispositivo, mas após terem decidido que o autoteste contra covid-19 seria parte da campanha de rastreamento da doença. O resultado apresentado pelo produto seria meramente para triagem de contaminados, adverte a agência. “Os produtos para autoteste são para o acompanhamento das condições de uma doença ou detecção de condições específicas, com a intenção de auxiliar o paciente, porém não conclusivo para o diagnóstico, podendo ser realizado por leigos”, ressaltou.
O Brasil tem uma legislação rígida para o registro de autotestes. Atualmente, exames deste tipo são proibidos pela Anvisa, mas testes para gravidez e diabetes são autorizados. O país atravessa, neste momento, um novo pico de casos da covid-19, motivados pela transmissão comunitária da varante ômicron, mais infecciosa que as anteriores, mas aparentemente menos danosa e mortal, de acordo com pesquisas preliminares.
Apesar de terem sido desenvolvidas antes que as atuais vacinas, laboratórios que fabricam os imunizantes indicam que a aplicação das doses gera uma maior carga de proteção contra a nova cepa do vírus.